Атомдук молекулярдык окуу
Атомдук-молекулярдык окуу – заттардын дискреттүү түзүлүшү жөнүндөгү табият таануунун теориялык концепцияларынын жыйындысы.
М.В.Ломоносов, Ж.Дальтон, А.Лавуазье, Ж.Пруст, А.Авогадро, Ж.Берцелиус, Д.И.Менделеев, А.М.Бутлеров жана башка көптөгөн адамдар атомдук-молекулалык изилдөөлөрдүн өнүгүшүнө чоң салым кошушкан.
Зат жеке бөлүкчөлөрдөн - атомдордон турат деген түшүнүк Байыркы Грецияда 5-кылымда пайда болгон. BC д. Атомизмди байыркы грек философиясынын өкүлдөрү Левкипп (б. з. ч. 500-440) жана анын окуучусу Демокрит (б. з. ч. 460-370) түзгөн.
Левкипп материянын ар бир бөлүкчөсүн, канчалык кичине болсо да, андан да кичине бөлүкчөлөргө бөлүүгө болобу деп ойлонгон. Левкипп мындай бөлүнүүнүн натыйжасында мынчалык кичинекей бөлүкчө алынышы мүмкүн жана андан ары бөлүнүү мүмкүн болбой калат деп ишенген.
Тарыхы
[түзөтүү | булагын түзөтүү]Антикалык атомистика
[түзөтүү | булагын түзөтүү]Зат жеке бөлүкчөлөрдөн - атомдордон турат деген түшүнүк Байыркы Грецияда 5-кылымда пайда болгон. BC д. Атомизмди байыркы грек философиясынын өкүлдөрү Левкипп (б. з. ч. 500-440) жана анын окуучусу Демокрит (б. з. ч. 460-370) түзгөн.
Левкипп материянын ар бир бөлүкчөсүн, канчалык кичине болсо да, андан да кичине бөлүкчөлөргө бөлүүгө болобу деп ойлонгон. Левкипп мындай бөлүнүүнүн натыйжасында мынчалык кичинекей бөлүкчө алынышы мүмкүн жана андан ары бөлүнүү мүмкүн болбой калат деп ишенген.
Левкипптин окуучусу, философ Демокрит бул кичинекей бөлүкчөлөрдү «атом» (атомос-бөлүнбөс) деп атаган. Ал ар бир элементтин атомдорунун өзгөчө өлчөмдөрү жана формалары бар жана бул заттардын касиеттериндеги айырмачылыктарды түшүндүрөт деп ишенген. Биз көргөн жана сезген заттар ар түрдүү элементтердин атомдору бири-бири менен бириккенде пайда болот жана бул байланыштын мүнөзүн өзгөртүү менен бир зат экинчи затка айланышы мүмкүн.

Левкипп, Демокрит жана Эпикур материалдын катуулугу анын курамындагы атомдордун формасына туура келет деп эсептешкен. Ошентип, темир атомдору катуу жана бекем, аларды катуу затка бекиткен илгичтери бар, суу атомдору жылмакай жана тайгак, туз атомдору даамынан улам курч жана учтуу, аба атомдору жеңил жана айланат, башка бардык материалдарга кирип кетет. . Бул көз караштын негизги жактоочусу Демокрит болгон. Сезимдик тажрыйбага таянган аналогияларды колдонуп, ар кандай заттардын атомдорун бири-биринен формасы, өлчөмү жана бөлүктөрүнүн жайгашуусу боюнча айырмаланган. Мындан тышкары, байланыштар материалдык байланыштар менен түшүндүрүлгөн, аларда жеке атомдор тиркемелер менен камсыз болгон: кээ бирлери илгичтери жана кулактары менен, башкалары шарлар жана уялар менен.
Дискреттүүлүк идеясынын дагы бир ишке ашырылышы Эмпедоклдун, Платондун жана Аристотелдин элементтер-сапаттар жөнүндөгү теориялары болгон, бирок алар материя түшүнүгүн жана анын курамын иштеп чыгууда өзүнчө багытты түзүп, ошону менен алхимиялык идеяларга негиз түзүшкөн. заттардын которулушу жөнүндө.
17-18-кылымдарда атомисттик гипотезанын калыптанышы
[түзөтүү | булагын түзөтүү]XVII-кылым
[түзөтүү | булагын түзөтүү]Схоластиканын күчөшү жана Рим империясынын кулашы менен атомдук теория көптөгөн кылымдар бою ар кандай төрт элементтүү теориялардын жана кийинчерээк алхимиялык теориялардын пайдасына четке кагылган. Бирок, 17-кылымда изилдөөчүлөр кайрадан атом теориясына кайтып келишти, биринчи кезекте Пьер Гассенди менен Исаак Ньютондун эмгектеринин аркасында. Ошол мезгилдеги башка илимпоздордон П.Гассенди байыркы тарыхты терең изилдеп, Эпикурдун натурфилософиясы боюнча негизги эмгектерди жазып, анын идеяларынын үгүтчүсү болгон. Ал боштукта кыймылдаган атомдордун өлчөмүн жана формасын эсепке алуу үчүн заттын өзүнүн касиеттерин да эске алууга болот деп негиздеген. Жылуулук майда, тегерек атомдор менен, ал эми муздак учтары учтары бар пирамида сымал атомдор менен байланыштырылган, бул катуу сууктан тиштин сезилишин түшүндүргөн, ал эми катуу заттар бири-бирине чырмалышкан илгичтер аркылуу кармалып турган.
Ньютон ошол кезде мода болуп турган атомдук тиркелүүнүн ар кандай теорияларын, б.а. «байланышкан атомдор», «жабышкан атомдор» (тынч абалындагы денелер) жана «координацияланган кыймылдар аркылуу бири-бирине жабышып калуу» теориясын тааныганы менен, Анын 1704-жылдагы «Оптикасында» жакшы айтылгандай, бөлүкчөлөр кандайдыр бир күч менен тартылат деп ишенишкен, ал «түз тийүү учурунда өтө күчтүү, кыска аралыкта ал химиялык өз ара аракеттенүүнү жүзөгө ашырат жана бөлүкчөлөргө кандайдыр бир сезилет. таасири."
Бирок тагыраак айтканда, агрегаттар же байланган атомдордун бирдиктери, б.а. биз бүгүн айта тургандай «молекулалар» түшүнүгү Роберт Бойлдун 1661-жылы өзүнүн атактуу «Скептик химик» трактатындагы гипотезасынан келип чыккан. бөлүкчөлөрдүн кластерлеринен (кластерлерден) турат жана химиялык өзгөрүүлөр бул кластерлердин кайра түзүлүшүнүн натыйжасы болуп саналат. Р.Бойл материянын негизги элементтери «корпускулалар» деп аталган ар кандай типтеги жана чоңдуктагы бөлүкчөлөрдөн турат, алар топторго бөлүнөт деп ырастаган.
1680-жылы француз химиги Николас Лемери корпускулярдык теорияны негиз кылып алып, ар кандай заттын кычкылдуулугу анын курчуган бөлүкчөлөрүндө, ал эми щелочтор ар кандай өлчөмдөгү тешикчелер менен жабдылганын аныктаган. Бул көз карашка ылайык, молекула чекиттер менен тешиктердин геометриялык байланышы аркылуу бириккен корпускулалардан турган.
XVIII-кылым
[түзөтүү | булагын түзөтүү]
Байланышкан "атомдордун айкалышы" идеясынын алгачкы прекурсорлору "химиялык жакындык унификациясы" теориясы болгон. Мисалы, 1718-жылы Бойлдун кластердик комбинациялар концепциясына таянып, француз химиги Этьен Франсуа Жеффруа бөлүкчөлөрдүн комбинацияларын түшүндүрүү үчүн химиялык жакындык теориясын иштеп чыгып, белгилүү бир алхимиялык «күч» белгилүү алхимиялык компоненттерди өзүнө тартат деп эсептеген. Джеффройдун ысымы 1718-1720-жылдары Француз академиясына тартуулаган таблицалары менен белгилүү. Булар заттардын бири-бирине болгон аракетине байкоолорду салыштыруу жолу менен түзүлгөн тизмелер, ар кандай реагенттерге окшош органдар көрсөткөн ар кандай жакындык даражаларын көрсөтүүчү. Бул таблицалар Клод Бертолле тарабынан киргизилген тереңирээк түшүнүктөр менен алмаштырылган кылымдын аягына чейин күчүндө болгон.
XIX-кылымда атомисттик гипотеза
[түзөтүү | булагын түзөтүү]Илимий теорияны түзүү 18-19-кылымдарда физика жана химия так эксперименталдык маалыматтарга негиздене баштаганда гана мүмкүн болгон.
Атомдук гипотезанын эксперименталдык ырастоосун англиялык химик Джон Далтон тапкан. 19-кылымдын башында Дальтон бир нече жаңы эмпирикалык мыйзамдарды ачкан: жарым-жартылай басым мыйзамы (Дальтон мыйзамы), газдардын суюктукта эригичтик мыйзамы (Генри-Дальтон мыйзамы) жана акырында көп катыштар мыйзамы (1803-ж.) ). Бул мыйзам ченемдүүлүктөрдү (биринчи кезекте, эселик катыштар мыйзамы) материянын дискреттүүлүгү жөнүндөгү божомолго кайрылбастан түшүндүрүү мүмкүн эмес. 1808-жылы Далтон өзүнүн атомисттик гипотезасын «Химиялык философиянын жаңы системасы» деген эмгегинде көрсөткөн.
Далтондун теориясынын негизги жоболору төмөндөгүлөр болгон (атомдук-молекулалык доктрина заттардын дискреттүүлүгү (структурасынын үзгүлтүксүздүгү) принцибине негизделген):
- Кандайдыр бир зат үзгүлтүксүз нерсе эмес, жеке өтө майда бөлүкчөлөрдөн турат – бардык заттар көп сандагы атомдордон (жөнөкөй же татаал) турат.
- Заттардын ортосундагы айырма алардын бөлүкчөлөрүнүн айырмасынан келип чыгат.
- Бир заттын атомдору толугу менен окшош. Жөнөкөй атомдор таптакыр өзгөрбөс жана бөлүнгүс.
- Ар кандай заттардын бөлүкчөлөрү (атомдору) массасы боюнча да, касиеттери боюнча да айырмаланат.
- Ар кандай элементтердин атомдору бири-бири менен белгилүү катышта бириге алышат.
- Атомдордун эң негизги касиети – алардын атомдук салмагы.
1803-жылы кээ бир элементтердин жана бирикмелердин салыштырмалуу атомдук салмагынын биринчи таблицасы Далтондун лабораториялык журналында пайда болгон (суутектин атомдук салмагы бир деп кабыл алынган). Далтон химиялык элементтердин символдорун ичинде ар кандай формадагы тегерекчелер түрүндө киргизген. Андан кийин, Далтон элементтердин атомдук салмагын бир нече жолу оңдогон, бирок көпчүлүк элементтер үчүн туура эмес маанилерди берген.
A. Авогадронун чыгармалары
[түзөтүү | булагын түзөтүү]Амедео Авогадро "молекула" деген жаңы сөздү сунуштады. Партингтондун «Химиянын кыскача тарыхы» аттуу китебине ылайык, 1811-жылы жазылган «Эссе боюнча молекулалардын элементардык денелеринин салыштырмалуу массаларын аныктоо» деген макаласында ал негизинен мындай дейт:
Газдардын эң кичине бөлүкчөлөрү сөзсүз эле жөнөкөй атомдор эмес, бул атомдордун белгилүү бир санынан түзүлүп, тартылуу аркылуу бир молекуланы пайда кылышат.
Бул цитата сөзмө-сөз котормо эмес экенин эске алыңыз. Авогадро атомдор жана молекулалар үчүн "молекула" атын колдонот. Тактап айтканда, атомдорго карата «элементардык молекула» деген терминди колдонот жана маселени татаалдаштыруу үчүн «кошулган атомдор» жана «кошулган молекулалар» жөнүндө да сөз кылат.
Верчеллиде жүргөндө Авогадро кыскача жазуу (меморандум) жазып, анда биз азыр Авогадро мыйзамы деп атаган нерсе жөнүндө гипотезаны белгилеген: бирдей температурада жана басымда бирдей көлөмдөгү газдар бирдей сандагы молекулаларды камтыйт. Бул мыйзам бирдей температурада жана басымда түрдүү газдардын бирдей көлөмдөрүнүн салмактарынын ортосунда пайда болгон катыш тиешелүү молекулалык салмактардын ортосундагы катышка туура келерин билдирет. Демек, салыштырмалуу молекулярдык салмактарды азыр газ үлгүлөрүнүн массаларынан эсептөөгө болот.
Авогадро бул гипотезаны Дж.Л.Гей-Люссактын 1808-жылдагы көлөмдөр жана газ айкалыштары жөнүндөгү мыйзамын Дальтондун 1803-жылкы атомдук теориясы менен айкалыштыруу үчүн иштеп чыккан. Авогадро туш болгон эң чоң кыйынчылык ошол кездеги атомдор жана молекулалар жөнүндөгү чоң башаламандык болгон. Авогадронун эмгегинин эң маанилүү салымдарынын бири жөнөкөй заттар атомдордон турган молекулалардан да турушу мүмкүн деп эсептеп, бири менен экинчисинин ортосундагы так айырмачылык болгон. Далтон болсо бул мүмкүнчүлүктү ойлогон эмес. Кызыгы, Авогадро жуп сандагы атомдорду камтыган молекулаларды гана карайт; ал так сандар эмне үчүн калтырылганын айтпайт.

1826-жылы Авогадронун эмгектерине таянып, француз химиги Жан-Батист Дюма мындай дейт:
Бирдей шартта газдар бирдей аралыкта жайгашкан молекулалардан же атомдордон турат, бул алардын бирдей көлөмдө бирдей өлчөмдө камтылышына барабар.
Бул концепцияларга ылайык, 1833-жылы француз химиги Марк Антуан Огюст Годен жарым-жартылай туура молекулярдык геометрияны (сызыктуу суунун молекуласы) жана туура молекулярдык формулаларды даана көрсөткөн "көлөмдүк диаграммаларды" колдонуу менен Авогадронун атомдук салмактар жөнүндөгү гипотезасын так баяндаган. H2O:
Фридрих Август Кекуле өзүнүн "элементтердин атомдук теориясын" (1857-1858) сүрөттөгөн эки эмгегинде органикалык молекуладагы ар бир атомдун башка атомдор менен кандай байланышы бар экендиги жөнүндөгү теорияны биринчилерден болуп сунуш кылган. Ал органикалык кошулмалардагы көмүртек атомдору тетраваленттүү жана бири-бири менен байланышып, молекулалардын көмүртек скелеттерин түзө алат деп сунуштады.
Карлсруэдеги химиктердин конгресси
[түзөтүү | булагын түзөтүү]С 3 по 5 сентября 1860 года состоялся Международный съезд химиков в Карлсруэ. Это была первая международная конференция, посвященная химии. Большое влияние на ход конгресса оказал итальянский химик Канниццаро. Он на основе закона Авогадро чётко разграничил понятия «атом», «молекула» и «эквивалент» и предложил рациональную систему атомной массы. Свою теорию он изложил в брошюре, которую лично раздал всем участникам конгресса. В своих выступлениях Канниццаро отстаивал закон Авогадро и систему Жерара и указывал на то, что возвращать химию к принципам Берцелиуса нецелесообразно. В целом конгресс положительно отнесся к идеям Канниццаро. Результатом съезда химиков в Карлсруэ стало утверждение атомно-молекулярного учения, были определены понятия атомного веса, а также молекулы и атома. Было установлено, что молекула — это наименьшее количество вещества, вступающее в реакции и определяющее физические свойства, а атом — наименьшее количество элемента, содержащееся в молекулах.
19-кылымдын экинчи жарымындагы химиктердин эмгектери
[түзөтүү | булагын түзөтүү]
В 1856 году шотландский химик Арчибальд Купер начал исследования по бромированию бензола в лаборатории Шарля Вюрца в Париже. Через месяц после выхода второй статьи Кекуле была опубликована независимая и в значительной степени идентичная теория молекулярного строения Купера. Он предложил очень конкретную идею молекулярной структуры, предположив, что атомы соединяются друг с другом подобно конструктору в определенных трехмерных конструкциях. Купер был первым, кто использовал линии между атомами, в сочетании со старым методом использования скобок, для представления связей, а также постулировал прямые цепочки атомов как структуры одних молекул, кольцеобразные молекулы других, таких как винная кислота и циануровая кислота. В более поздних публикациях связи Купера были представлены с помощью прямых пунктирных линий (хотя неизвестно, является ли это предпочтением наборщика), например, спирт или щавелевая кислота:
Арчибальд Купердин атомдор үчүн элементардык символдорду жана байланыштар үчүн сызыктарды колдонуу менен спирт жана оксал кислотасы үчүн молекулалык структуралары (1858).
1861-жылы Вена орто мектебинин Жозеф Иоганн Лошмидт аттуу белгисиз мугалими өз каражаты менен "Хемише Студиен I" аттуу брошюраны басып чыгарды, анда "шакекче" түзүмдөрдү да, кош байланыштары бар структураларды да көрсөткөн жаңы молекулярдык сүрөттөр камтылган, мисалы:

Лошмидт ошондой эле бензол үчүн мүмкүн болгон формуланы сунуштаган, бирок бул суроону ачык калтырган. Бензолдун заманбап түзүлүшү боюнча биринчи сунушту 1865-жылы Август Кекуле жасаган. Бензолдун циклдик табиятын акыры кристаллограф Кэтлин Лонсдейл тастыктаган. Бензол - бул бардык байланыштарды эсепке алуу үчүн кош көмүртектүү байланыштарды алмаштырууну талап кылган өзгөчө көйгөй:
1865-жылы немис химиги Август Вильгельм фон Хофман биринчи болуп Улуу Британиянын Королдук институтунда метан сыяктуу лекцияларда колдонгон молекулалардын шар таягы моделдерин жасаган:
Бул модель 1855-жылы анын кесиптеши Уильям Одлинг тарабынан айтылган көмүртек тетраваленттүү деген божомолго негизделген. Гоффмандын түс схемасы ушул күнгө чейин колдонулат: көмүртек – кара, азот – көк, кычкылтек – кызыл, хлор – жашыл, күкүрт – сары, суутек – ак. Хоффмандын моделиндеги кемчиликтер негизинен геометриялык болгон: көмүртек байланыштары тетраэдрдик эмес, бир тегиздикте көрсөтүлгөн жана атомдук өлчөмдөр пропорционалдуу эмес, мисалы, көмүртек суутектен кичине болгон.
1864-жылы шотландиялык органикалык химик Александр Крум Браун молекулалардын сүрөттөрүн тарта баштаган, анда ал атомдордун символдорун тегерекчелерге киргизген жана атомдорду ар бир атомдун валенттүүлүгүн канааттандыра тургандай туташтыруу үчүн сынык сызыктарды колдонгон. 1873-жыл, көптөгөн сын-пикирлер боюнча, "молекула" түшүнүгүнүн өнүгүү тарыхында бурулуш учур болгон. Бул жылы атактуу шотландиялык физик Джеймс Клерк Максвелл өзүнүн атактуу "Молекулалар" деген макаласын Nature журналынын сентябрь айындагы санына жарыялады. Максвелл бул макаланын кириш бөлүмүндө ачык-айкын айтат:
Атом – жарымынан бөлүүгө болбой турган дене; молекула белгилүү бир заттын мүмкүн болгон эң кичине бөлүгү.
Демокриттин атомдук теориясы жөнүндө сөз кылгандан кийин Максвелл бизге «молекула» деген сөздүн заманбап сөз экенин айтууну улантат.
1874-жылы Джейкоб Хендрик Вант Хофф жана Жозеф Ахиллес Ле Бел [en] өз алдынча оптикалык активдүүлүк кубулушун көмүртек атому менен анын кошуналарынын ортосундагы химиялык байланыштар кадимки тетраэдрдин бурчтарына багытталган деп айтуу менен түшүндүрүүгө болот деп сунушташкан. . Бул молекулалардын үч өлчөмдүү табиятын жакшыраак түшүнүүгө алып келди.
Эмиль Фишер молекулалардын үч өлчөмдүү түзүлүшүн тегиздикке чыгаруу үчүн өзүнүн техникасын иштеп чыккан:
1898-жылы Людвиг Больцман газ теориясы боюнча лекцияларында газ фазасынын молекулярдык диссоциациялануу кубулушун түшүндүрүү үчүн валенттүүлүк теориясын колдонгон жана муну менен атомдук орбиталдардын бири-бирин кайталаган алгачкы примитивдүү, бирок деталдуу чиймелеринин бирин тарткан. Баарынан мурда молекулярдык йод бууларынын атомдорго жогорку температурада диссоциациялануу фактысын белгилеп, Больцман эки атомдон турган молекулалардын, Больцман айткандай, «кош атомдун» болушун таасир этүүчү тартылуу күчү менен түшүндүрүшүбүз керек деп ырастайт. эки атомдун ортосунда... Больцман бул химиялык тартылуу, химиялык валенттүүлүктүн кээ бир фактыларынан улам, сезгич аймак деп аталган атомдун бетиндеги салыштырмалуу кичинекей аймак менен байланыштуу болушу керек деп ырастайт.
Больцман бул «сезимтал аймактын» атомдун бетинде болоорун же жарым-жартылай атомдун ичинде болушу мүмкүн жана ага бекем туташып турганын жактайт. Тактап айтканда, ал мындай дейт: "Эки атом алардын сезгич аймактары бири-бирине тийип же жарым-жартылай бири-бирине бири-бирине тийе тургандай тизилгенде гана алардын ортосунда химиялык тартылуу болот. Анан биз алар бири-бири менен химиялык байланышта деп айтабыз. Бул схема төмөндө майда-чүйдөсүнө чейин берилип, α - А атомунун сезгич аймагы, В атомунун β-сезгич аймагы менен кабатталган:
Классикалык химиянын доору
[түзөтүү | булагын түзөтүү]20-кылымдын башында америкалык химик Гилберт Ньютон Льюис Гарварддын студенттерине атомдордун айланасында электрондорду көрсөтүүнү үйрөткөндө, аларды чекиттер менен символдоштура баштаган. Анын окуучулары ушул чиймелерге артыкчылык берип, аны ушул багытта шыктандырган. Бул лекциялардан Льюис белгилүү бир сандагы электрондору бар элементтер өзгөчө туруктуу болуп көрүнөөрүн белгиледи. Бул кубулушту 1904-жылы немис химиги Ричард Абегг белгилеген, аны Льюис "Абегдин валенттүүлүк мыйзамы" деп атаган (азыр көбүнчө Абеггдин эрежеси деп аталат). Льюиске ядронун айланасында сегиз электрондон турган ядро пайда болору менен катмар толуп, жаңы катмар башталгандай көрүнгөн. Lewis ошондой эле сегиз электрон менен ар кандай иондор да өзгөчө туруктуу болуп көрүнөт деп белгиледи. Ушул көз караштарга таянып, ал «сегиздик эрежени» же «октеттик эрежени» сунуш кылган: сегиз электрондон турган толтурулган катмары бар иондор же атомдор өзгөчө туруктуу.
Болгондо да кубдун сегиз бурчу бар экенин байкаган Льюис атомду кубдун бурчу сыяктуу электрондор үчүн жеткиликтүү болгон сегиз тарабы бар деп элестеткен. Андан кийин, 1902-жылы, ал куб атомдор куб структуралуу молекулаларды пайда кылуу үчүн, алардын капталдары менен бириге алат деген концепцияны иштеп чыккан.
Башка сөз менен айтканда, электрондук жуп байланыштар түзүлүшү С (төмөндө) сыяктуу эки атомдун жалпы чек арасы пайда болгондо түзүлөт. Бул эки электрондун бөлүнүшүнө алып келет. Ошо сыяктуу эле, заряддуу иондук байланыштар электрондун бир кубдан экинчисине А-нын четтерин ажыратпастан өткөндө пайда болот. Бир гана бурч бөлүнгөн В аралык абалды да Льюис айткан.
Демек, кош байланыштар эки куб атомдун ортосундагы жүзүн бөлүшүү менен пайда болот. Бул төрт электрондун бөлүнүшүнө алып келет.
1913-жылы, Берклидеги Калифорния университетинде химия бөлүмүнүн башчысы болуп иштеп жүргөндө Льюис Берклиде бир жыл болгон англиялык аспирант Альфред Лаук Парсондун макаласынын алдын ала долбоорун окуган. Бул макалада Парсон электрондун жөн эле электр заряды эмес, кичинекей магнит (же ал аны "Магнетон" деп атаган) жана андан тышкары, химиялык байланыш эки атомдун ортосундагы эки электрондун бөлүштүрүлүшүнөн пайда болот деп сунуш кылган. Ал эми бул, Льюис боюнча, байланыш эки электрон эки толук куб ортосунда жалпы кыр пайда болгондо пайда болот дегенди билдирген.
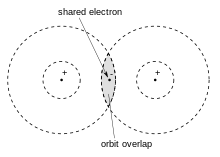
Ушул көз караштарды эске алуу менен, 1916-жылы чыккан «Атом жана молекула» деген атактуу эмгегинде Льюис атомдорду жана молекулаларды көрсөтүү үчүн «Льюис структурасын» киргизген, мында чекиттер электрондорду, ал эми сызыктар коваленттик байланыштарды билдирет. Бул макалада ал электрон жуп байланыш түшүнүгүн иштеп чыккан, анда эки атом бирден алтыга чейин электронду бөлүшө алат, ошону менен бир электрондук байланышты, бир, кош же үчтүк байланышты түзөт.
Льюистин өзү айткандай:
Электрон эки башка атомдун кабыгынын бир бөлүгү болушу мүмкүн жана ал алардын бирине гана таандык деп айтууга болбойт."

Мындан тышкары, ал атомдун кубду бүтүрүү үчүн керектүү электрондордун бир бөлүгүн алып же жоготуп, ион түзүүгө умтулат деп божомолдогон. Ошентип, Lewis структуралары анын химиялык белгисин колдонуп, бир молекуланын структурасында ар бир атомду көрсөтөт. Бири-бири менен байланышкан атомдордун ортосунда сызыктар тартылат; кээде сызыктардын ордуна жуп чекиттер колдонулат. Жалгыз жуптарды түзгөн ашыкча электрондор жуп чекиттер катары көрсөтүлөт жана алар жайгашкан атомдордун жанына жайгаштырылат:
Жаңы коммуникация модели жөнүндөгү көз карашын жыйынтыктап, Льюис мындай дейт:
Эки атом электрондорду бир атомдон экинчи атомго өткөрүү менен гана эмес, бир же бир нече жуп электронду бөлүшүү аркылуу да «сегиздик эрежеге» же «октеттик эрежеге» жооп бере алат... Эки атомдук борбордун ортосунда ушундай жол менен туташкан эки электрон жана эки атомдун кабыкчасында чогуу кармалып, мен аны химиялык байланыш катары карадым. Ошентип, биз органикалык химиктин ишенимдеринин бир бөлүгү болгон бул физикалык жандыктын, ошол «илмек менен көздүн» конкреттүү сүрөтүнө ээ болдук.
Кийинки жылы, 1917-жылы, ошол кездеги белгисиз америкалык инженер-химиялык инженер Линус Полинг Орегон айыл чарба колледжинде Далтондун илгич-көз байланышын изилдеген. Ар бир атомдун башка атомдорго туташуусуна мүмкүндүк берген белгилүү бир сандагы «илгичтери» жана башка атомдордун ага жабышып калышына мүмкүндүк берген белгилүү сандагы «кулактары» болгон. Химиялык байланыш илгич менен кулактын биригишинен пайда болгон. Бирок Л.Полинг бул архаикалык ыкмага канааттанбай, билимдин жаңыдан пайда болгон тармагына – кванттык физикага жаңы ыкмага кайрылган.
1927-жылы немис физиктери Фриц Лондон жана Вальтер Хайтлер кванттык механиканын ыкмаларын тартуунун жана түртүүнүн каныккан, динамикалык эмес күчтөрүн изилдөө үчүн колдонушкан, б.а., алардын биргелешкен иштеринде бул маселенин валенттик байланышын кароонун мааниси чоң болгон. химияны кванттык механикага алып келди ... Алардын иши Л.Полингге таасир эткен, ал жаңы эле докторлук даражасын алган жана Гуггенхайм стипендиясы боюнча Цюрихте В.Гейтлер менен Ф.Лондонго барган.
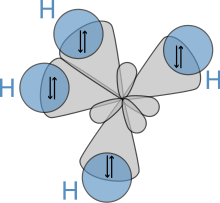
Кийинчерээк, 1931-жылы В.Гейтлер менен Ф.Лондондун эмгектерине жана Г.Льюистин атактуу макаласында табылган теорияларга таянып, Полинг өзүнүн «Химиялык байланыштын табияты» аттуу пионердик макаласын жарыялап, анда ал кванттык механиканы колдонгон. байланыштар ортосундагы бурчтар жана байланыштардын айланасында айлануу сыяктуу молекулалардын касиеттерин жана структураларын эсептей алат. Бул концепциялардын негизинде Л.Полинг CH4 сыяктуу молекулалардагы байланыштарды эсепке алуу үчүн гибриддештирүү теориясын иштеп чыкты, анда төрт гибриддештирилген sp3 орбиталдары 1s суутек орбиталдары менен кабатталып, төрт σ-байланыш түзүлөт. Бул төрт байланыш бирдей узундукта жана күчтө, натыйжада төмөндө көрсөтүлгөндөй молекулярдык түзүлүш пайда болот:
Бул уникалдуу теориялардын аркасында Л.Полинг 1954-жылы химия боюнча Нобель сыйлыгын алган. Белгилей кетчү нерсе, ал 1963-жылы Нобель Тынчтык сыйлыгын алган эки Нобель сыйлыгын алган жалгыз адам болгон.
1926-жылы француз физиги Жан Перрен молекулалардын бар экендигин ынанымдуу далилдегени үчүн физика боюнча Нобель
сыйлыгын алган. Ал муну ар бири суюк фазалык системаларды камтыган үч башка ыкманы колдонуу менен Авогадронун санын
эсептөө менен жасады. Биринчиден, ал гиммигут самынынын эмульсиясын колдонгон, экинчиден, броун кыймылы боюнча
эксперименталдык иштерди жүргүзгөн, үчүнчүдөн, Эйнштейндин суюк фазадагы бөлүкчөлөрдүн айлануусу жөнүндөгү
теориясын ырастаган.
Негизги жоболор
[түзөтүү | булагын түзөтүү]Атомдук-молекулярдык теория төмөнкү мыйзамдарга жана жоболорго негизделген:
- Бардык заттар атомдордон турат
- Бир химиялык заттын (химиялык элементтин) атомдору бирдей касиетке ээ, бирок башка заттын атомдорунан айырмаланат
- Атомдор өз ара аракеттенгенде молекулалар пайда болот (гомонуклеардык - жөнөкөй заттар, гетеронуклеардык - татаал заттар)
- Физикалык кубулуштарда молекулалар өзгөрбөйт, химиялык кубулуштарда алардын курамы өзгөрөт.
- Химиялык реакциялар баштапкы заттар турган атомдордон жаңы заттардын пайда болушунан турат.
- Массанын сакталуу закону – химиялык реакцияга кирген заттардын массасы реакциянын натыйжасында пайда болгон заттардын массасына барабар.
- Курамдын туруктуулук мыйзамы (көп катыштар мыйзамы) - ар кандай белгилүү химиялык таза кошулма, аны алуу ыкмасына карабастан, бирдей химиялык элементтерден турат жана алардын массаларынын катыштары туруктуу, ал эми алардын салыштырмалуу сандары. атомдор бүтүн сандар менен көрсөтүлөт
- Аллотропия – бир эле химиялык элементтин түзүлүшү жана касиеттери боюнча бир нече жөнөкөй заттар түрүндө болушу.
Келип чыккан мыйзамдар жана жоболор
[түзөтүү | булагын түзөтүү]Азыркы кванттык-механикалык концепциялар боюнча, молекуладагы атомдор үчүн өзөк гана, башкача айтканда, ядро жана ички электрон кабыкчалары аздыр-көптүр өзгөрүүсүз калат, ал эми тышкы (валенттүүлүк) электрондордун кыймылынын мүнөзү түп тамырынан бери өзгөрөт. Ошентип, жаңы (өзүнчө болгон сыяктуу) бүт молекуланы каптаган молекулалык электрондук кабык пайда болот (кара. Химиялык байланыш). Бул жагынан алганда, молекулаларда туруктуу атомдор жок.
- Авогадро мыйзамы (көлөмдүк мамилелердин мыйзамы)
- Салыштырмалуу атомдук масса
- Моль (бирдик)
- Эквиваленттер мыйзамы
Доказательство существования атомов и молекул
[түзөтүү | булагын түзөтүү]Левкипп менен Демокриттин атомдор жөнүндөгү теориясы эксперименталдык жактан тастыкталган эмес, анткени байыркы гректер такыр эксперимент жүргүзүшпөгөндүктөн, алар ойду байкоодон жогору коюшкан.
Заттын атомдук табиятын тастыктаган биринчи эксперимент 2000 жылдан кийин гана жасалган. 1662-жылы ирландиялык химик Роберт Бойл (1627-1691) сымап колоннасынын басымы астында U түрүндөгү түтүктөгү абаны кысып жатып, түтүктөгү абанын көлөмү басымга тескери пропорционал экенин аныктаган:
Француз физиги Эдм Марриот (1620-1684) бул байланышты Бойлдон 14 жылдан кийин тастыктап, анын туруктуу температурада гана сакталарын белгилеген.
Бойл Мариотт тарабынан алынган натыйжаларды, эгерде аба атомдордон турганы, алардын ортосунда бош мейкиндик бар экендиги таанылганда гана түшүндүрүлөт. Абанын кысылышы атомдордун жакындашынан жана бош мейкиндиктин көлөмүнүн азайышынан келип чыгат.
